FDA査察官も使うツールで監査の準備を、UL Japanのオンライントレーニング:MEDTEC Japan 2014開催直前情報
ここ数年、米国で使用される医療機器に対する、FDA(米国食品医薬品局)の査察の頻度が増えている。米国向けに医療機器を輸出する日本の医療機器メーカーにとって、査察の対応は、手順が複雑なこともあり、手間のかかる作業になっている。そうしたFDAの査察に対応するためのサービスを展開しているのが、UL Japanだ。
2014年4月9~11日、医療機器の設計/製造に関する総合展示会「MEDTEC Japan 2014」が、東京ビッグサイトにて開催される。医療機器などに対して安全規格に準じた評価/認証を行うULのグループ会社であるUL Japanは、MEDTEC Japan 2014において、米国に医療機器を輸出するメーカー向けに、FDA(米国食品医薬品局)の査察に対応するためのサービスなどを紹介する。
FDA査察官も使うツールでトレーニングが可能
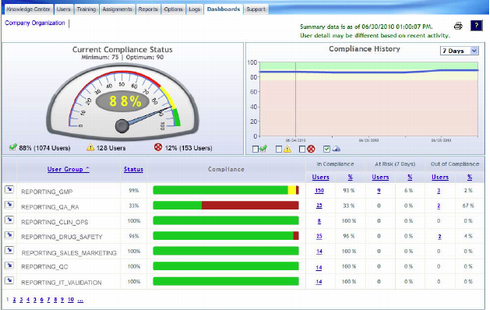
UL Japanが紹介するのは、査察への対応を支援するオンライントレーニングシステム「ComplianceWire」だ。FDAと提携して開発されたもので、「査察対応(基礎)コース」「QSR(品質システム規制)入門コース」「MDR(医療機器レポート)規制対応コース」など、約500種類のコースを準備している。これらの中には、FDAが監修したものも数多くあり、FDAの査察官が実際に使用しているトレーニングもある。UL Japanのライフ&ヘルスサイエンス事業部 ビジネス開発課 課長の小峰豊氏によれば、「ComplianceWireを使ってトレーニングを行ったFDA査察官は、この14年間で3万6000人に上る」という。
UL Japanは2013年に、ComplianceWireの日本語版の提供を開始した(関連記事:医療機器のFDA対応を効率化――UL JapanがFDA査察対応サービス)。背景には、米国で販売される医療機器に対するFDAの査察/監査が増えていることにある。ライフ&ヘルスサイエンス事業部 営業推進部の大原香苗氏は、「これまでは、FDAが日本の医療機器メーカーに査察に来る頻度は低かった。ここ数年はその頻度が増えていて、それに伴い、FDAの査察対応について当社に問い合わせてくるケースも多くなっている」と説明する。
UL Japanは2014年2月に、FDA査察の傾向と対策を解説するセミナーを開催した。その際、参加者からは「FDAのWebサイトは情報量が多すぎて、必要な事項を探し出せない」「そもそも査察について詳しく知りたい」といった声が多く聞かれたという。ULは30年以上にわたり、工業やライフサイエンス、ヘルスケアといった分野で学習マネジメントシステムを提供してきた。ComplianceWireは、ULのこうした実績を生かして、効率的にFDA査察対応を支援するシステムとして位置付けられている。
FDA査察の客観的な“証拠”に
ComplianceWireは複数の章から成り、テストを受けながらトレーニングを進めていく。修了すると修了証書が発行されるが、これによって特に何らかの公的資格が得られるわけではない。そもそも、ComplianceWireを受けることは法規制によって定められているわけでもない。
だが、FDAの査察の際に、製造を担当するオペレータの経験や力量を客観的に示す“証拠”として有効な書類となる。FDAの監査は非常に厳しく、書類で示すなど客観的に判断できる材料がなければ、“適合していない”とみなされるからだ。「FDAの監査では、“この業務を行うに当たってどのようなトレーニングを受けているのか”といった趣旨の質問を最初に尋ねられる。ComplianceWireのトレーニング記録を提示することで、効率的に監査を進めることができる。ComplianceWireでトレーニングを行っているFDA査察官も多いからだ」(小峰氏)。
なお、ComplianceWireは、FDAの連邦規則(21CFR Part11)にも適合している。21CFR Part11は、電子記録や電子署名、電子承認などを、手書き署名と同等のものとしてFDAが受け入れることを示すもの。別の人間が署名できる可能性があるなど、電子承認/署名に特有の問題に対応する規制として、1997年に配布、発行された。
今後は、医療機器のEMC試験にも注力
UL JapanがMEDTEC Japanに出展するのは3度目となる。2012年は、医療機器の適合性評価サービスを行っているということを紹介し、2013年は、医療機器市場に新たに参入したい国内メーカーに対するサポートやサービスについて展示した。今回は、過去2回の展示内容をさらに進化させ、海外、特に米国市場に医療機器を出荷したいメーカーに対して、支援やサービスを提示する場としていく。4月10日には、FDAの査察対応について入門セミナーも行う予定だ。
大原氏は、「MEDTEC Japanの展示の規模は年々大きくなっている。新規参入メーカーを含め、いろいろな方と情報を交換できると期待している」と語った。
さらにUL Japanは、医療機器のEMC(電磁両立性)試験に強い点もアピールしていく。「最近は、無線でデータをやり取りしたいというニーズが医療機器の分野でも増えている。EMCの測定は、もともとULが得意とする分野だ。電波法に対する問い合わせや、海外から輸入してきた医療機器のEMCについて知りたいという声が増えているので、こうしたニーズに応えられる試験や評価を行えるという点も、MEDTEC Japan 2014で強調していきたい」(大原氏)。
Copyright © ITmedia, Inc. All Rights Reserved.
Special Contents
- PR -Special Contents
- PR -Special Contents 1
- PR -Special Contents 2
- PR -Special Site
- PR -Pickup Contents
- PR -繧ウ繝シ繝翫�繝ェ繝ウ繧ッ
医療機器の記事ランキング
- ミカンの皮に含まれる成分で犬の認知症症状が改善
- 過疎地域の医療は持続可能? 北スウェーデンはモデルケースとなるか
- 診療科横断で患者の医療情報を一元管理するプラットフォームを発売
- 同じ速さでも、手で感じる動きの速さが変わる触覚錯覚を発見
- 人工膝関節手術支援ロボットを日本国内で販売開始
- フィジカルAIを活用した自律型画像診断の開発推進に向けた協力を開始
- タブレットのLiDARで呼吸時の体の動きを接触せずに可視化する技術
- 患者の長期管理を支援するECMO装置を発売、新型コロナなどの重症呼吸不全に対応
- 大阪・関西万博に、音や映像だけでなく触覚や振動を送り合える装置を設置
- AIを活用したノイズ低減処理を搭載するマンモグラフィ装置を発売

 認証機関からビジネスパートナーへ、UL Japanが新戦略
認証機関からビジネスパートナーへ、UL Japanが新戦略 医療機器のFDA対応を効率化――UL JapanがFDA査察対応サービス
医療機器のFDA対応を効率化――UL JapanがFDA査察対応サービス UL、日本で自動車/化学分析領域での事業を強化
UL、日本で自動車/化学分析領域での事業を強化