欧州NIS指令が医療規制対応にもたらすインパクト:海外医療技術トレンド(33)(3/3 ページ)
EU域内統一ルールと加盟国の個別法制の改変が続く複雑な規制環境
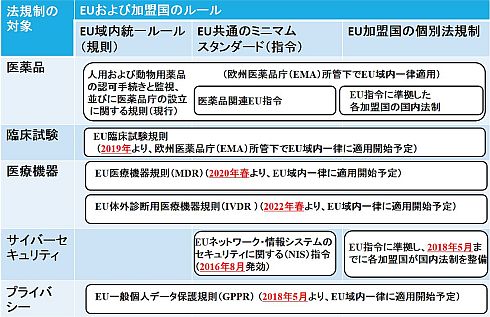
ここで、図4は、2018年3月時点の情報に基づき、欧州の医療機器/医薬品を取り巻くルールの関係を整理したものである。
GDPRは、EU域内の統一ルールだが、NIS指令はEU域内のミニマムスタンダードであり、実際の法令制定/運用や強制執行措置は各国当局に委ねられる。英国政府のように、サイバーセキュリティ関連法違反事案に対して、GDPR並みの制裁金を課す姿勢を示すケースもあり(関連情報)、各国政府の対応が注目される。
これに対して、医薬品の場合、英国ロンドンに本部を有する欧州医薬品庁(EMA)所管下で「人用および動物用薬品の認可手続きと監視ならびに医薬品庁の設立に関する規則」がEU域内に一律適用される仕組みをとってきた(関連情報)。ただしEMAは、英国のBrexit(EU脱退)に伴い、オランダのアムステルダムに移転する計画を発表しており(関連情報)、これまでロンドンに欧州事業の中核拠点を置いてきたEU域外医薬品企業も、何らかの対応を迫られている。
また、医療施設の臨床現場向けには、2014年4月、EU臨床試験規則(関連情報)が成立した。現行の臨床試験指令に基づく各加盟国の法規制体制から、2019年より、EMA所管下でEU域内一律適用体制に移行する計画を公表している。新たな臨床試験規則の特徴を挙げると以下の通りである。
- リスクの低い臨床試験に関する規制緩和(例:「低介入臨床試験」カテゴリーの導入)
- 臨床試験申請の統一化(EMAのEUポータル)
- 資料保存期間の長期化(5年から25年へ)
- 公開データベースへの登録・結果報告義務
これに対して、医療機器の場合、EU域内のミニマムスタンダードである「医療機器指令(MDD)」や「体外診断用医療機器指令(IVDD)」に基づく各加盟国の法規制体制から、EU域内統一ルールである「医療機器規則(MDR)」や「体外診断用医療機器規則(IVDR)の一律適用体制へ移行する計画を表明している(関連情報)。
デジタルヘルスに関しては、本連載第30回で紹介したように、「EUデジタルヘルス社会宣言」に代表される社会課題解決型デジタルヘルスの枠組み作りが進んでおり、本連載第27回で紹介した米国FDAのように、具体的なイノベーションのソリューション化/事業化に向けた動きとどうハーモナイズしていくかが注目される。
日本の医療機器企業やデジタルヘルス関連企業から見ると、GDPRやNIS指令は遠く離れた対岸の火事に感じられるかもしれないが、ICTを共通基盤とする薬事・医療機器規制の日米欧三極連携体制強化が進む中、日本国内で具体的影響が顕在化して初めて体制づくりを始めたのでは手遅れになる可能性がある。
筆者プロフィール
笹原英司(ささはら えいじ)(NPO法人ヘルスケアクラウド研究会・理事)
宮崎県出身。千葉大学大学院医学薬学府博士課程修了(医薬学博士)。デジタルマーケティング全般(B2B/B2C)および健康医療/介護福祉/ライフサイエンス業界のガバナンス/リスク/コンプライアンス関連調査研究/コンサルティング実績を有し、クラウドセキュリティアライアンス、在日米国商工会議所等でビッグデータのセキュリティに関する啓発活動を行っている。
Twitter:https://twitter.com/esasahara
LinkedIn:https://www.linkedin.com/in/esasahara
Facebook:https://www.facebook.com/esasahara
関連記事
- 連載「海外医療技術トレンド」バックナンバー
 社会課題解決型デジタルヘルスで注目されるEU、調整役はエストニア
社会課題解決型デジタルヘルスで注目されるEU、調整役はエストニア
次なる高齢化の波が押し寄せているEUでも、社会課題解決型デジタルヘルスの新たな取り組みが進んでいる。その調整役になっているのがエストニアだ。 トランプ政権下でも着々と進む米国のデジタルヘルス規制の枠組みづくり
トランプ政権下でも着々と進む米国のデジタルヘルス規制の枠組みづくり
「医療機器」と「非医療機器」の双方に重なり合うデジタルヘルス。米国では、イノベーション促進に向けた規制の枠組みづくりが本格化している。 バルト・北欧諸国でつながるヘルスデータ改革の波と持続可能な開発目標「SDGs」
バルト・北欧諸国でつながるヘルスデータ改革の波と持続可能な開発目標「SDGs」
ICTや健康医療・介護福祉の先進国が集中するバルト・北欧諸国は、ヘルスデータ交換基盤の標準化・共通基盤化でも、世界をけん引している。日本でも取り組みが始まった、持続可能な開発目標(SDGs)でも先行している。 デジタルヘルスと高齢化の施策で互いの将来を俯瞰するオーストラリアと日本
デジタルヘルスと高齢化の施策で互いの将来を俯瞰するオーストラリアと日本
世界各国で進んでいるデジタルヘルス推進施策だが、日本と同じアジア太平洋地域も同様だ。電子カルテ普及率が9割を超えるオーストラリアは、日本の将来を俯瞰する上で参考になる。オーストラリアにとっても、今後の課題となる高齢化施策は日本の取り組みが参考になりそうだ。 「WannaCry」に襲われた英国の地域医療連携システム、そこから何を学べるのか
「WannaCry」に襲われた英国の地域医療連携システム、そこから何を学べるのか
2017年10月に発生したランサムウェア「WannaCry」によるサイバー攻撃。被害事例として真っ先に挙げられたのが英国の医療機関だ。病院単体にとどまらず、地域医療連携システムにも影響が出た。そのとき、どのように対処し、今後のどのような対策を取ろうとしているのだろうか。
Copyright © ITmedia, Inc. All Rights Reserved.
医療機器の記事ランキング
- 画像診断支援AI技術の開発を支援するクラウドサービスの提供を開始
- 持続感染性を有するウイルスの獲得に成功
- ポータビリティ性を高めたラップトップ型汎用超音波画像診断装置
- 医療機器よりも難題!? Non-SaMDに影響が及ぶ米国のIoTセキュリティ政策
- 生体外でほぼ100%毛幹を生み出せる、毛包オルガノイドを作製
- 高エネルギー電子線をレーザーで発生、より安全ながん治療装置の確立へ
- 3ステップ約3分で40種類の薬物を尿から検出する手法を開発
- 内視鏡システムのクラウド化に関する実証実験を開始
- 医薬品向け製造、品質管理システムのサプスクリプション型サービスを開始
- トウモロコシ由来のオリゴペプチドが肥満や脂肪肝を改善する