規格だけでは安全性を保証できない:安全な医療機器設計と規格(1)(1/2 ページ)
安全な医療機器を設計するための指針として、さまざまな規格が策定されています。ですが、業界基準を満たす機器を設計するだけでは十分とはいえません。設計者は、リスクを特定し、それらを軽減する手法を採用する必要があります。
医療機器の設計には、驚くほど長い道のりをたどります。医療分野での経験が比較的浅い設計担当者は、設計した医療機器が「安全に使用できる」と認識されるまでにかかる長い過程を知って驚くかもしれません。例えば若手のエンジニアで、安全かつ規制に順守した機器を開発するのに、実験室で試作品を設計する場合と比べて、5〜10倍もの時間がかかると知っている人は少ないでしょう。
医療機器は、安全性を証明する試験を経て初めて、機器が安全だと認識されます。そのため、安全性を検討する場合、まずはそれを証明する適切な試験法を考案することから始まります。
安全工学の原理では、安全な設計に欠かせない重要なポイントが3つ、強調されています。
これらのポイントはハードウェア、ソフトウェア、ユーザーインタフェースに当てはまるものです。すなわち、1)医療ハードウェアでは、患者に危害を及ぼさないよう、2つの独立故障を許容しない機能的安全アプローチが取られています。2)ソフトウェア設計では規定が設けられていて、バグが原因で発生する危害の可能性を、許容可能なレベルにまで抑えています。最後に、3)ユーザーインタフェース設計では、マシンインタフェースをできる限り安全に保つユーザビリティ基準が推薦されています。
ただし、ここで重要なのは、医療分野の基準に沿って機器を設計することが、必ずしも安全性を保証することにはならないということです。
規格がどのように構成されているのかを考えれば、その理由が分かります。
規格は、専門家で構成された委員会によって制定されます。規格の制定過程には政治的な意図も含まれます。厳しい要件を要求するメンバーもいれば、もっと軽いものを要求するメンバーもいます。通常、詳細に至るまで合意されるには長い時間がかかります。そのため、規格の多くは発行時には既に期限切れとなっています。大抵の場合、規格で全てのリスクをカバーすることはできません。設計者は包括的なリスク分析を実施して、基準でカバーされていない分野を補う必要があるのです。
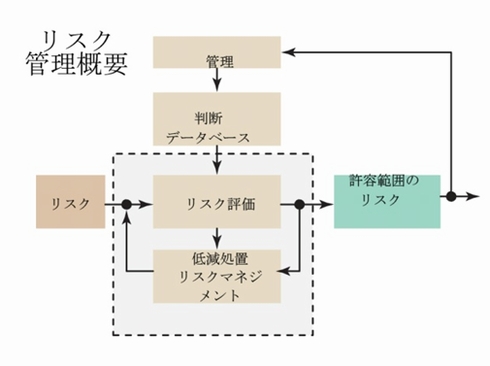
リスクの予測/評価
実質的に、リスクマネジメントとは、「全てのリスクを特定するために、設計者が複数のリスク分析方法を組み合わせたもの」ということになります。
医療分野では、「ISO 14971:2007」において、体外診断用医療機器(IVD機器)を含む医療機器に伴う危険性を製造業者が特定、それに伴うリスクを予測・評価し、これらのリスクを管理した後に、その管理の有効性をモニタリングするためのプロセスを規定しています。ISO 14971:2007の要件は、医療機器ライフサイクルの全段階に適用されます。ですが、医療機器の安全要件は、他の分野の製品と比べると、実はそれほど厳しいものではありません。
例えば、飛行機を製造する場合には、医療機器よりも厳しい安全要件が課されます。医療機器の場合、死亡に至ったとしても一度に1人ですが、安全性に欠けた民間航空機の場合、何百人という人が犠牲になる可能性があるからです。同様に、医療機器に対しては、患者に害が及ばないように2つの独立故障を防ぐ設計が要されますが、エレベータ設計の場合、3つの独立故障に対して安全性が保証されている必要があります。概して、複数人を死亡させる可能性がある場合には、安全性に対する要求もより厳しくなるのです。
Copyright © ITmedia, Inc. All Rights Reserved.