米国の医療DXを支えるブロックチェーンと分散台帳はオバマ政権時代からの積み重ね:海外医療技術トレンド(75)(3/5 ページ)
FDAが主導する医薬品サプライチェーン管理の効率化・自動化
HHSの部局レベルで、ブロックチェーン適用に向けた独自の取り組みを行ってきたのが食品医薬品局(FDA)である。その起点となったのが、偽造医薬品対策を目的として、2013年11月27日に制定された医薬品サプライチェーン安全保障法(DSCSA)だ。同法に基づいてFDAは、医療用医薬品に商品コード、ロット番号、有効期限、ランダム番号を含む2次元バーコードを表示し、医薬品製造業者から、再包装業者、卸売業者/サードパーティーロジスティクス・プロバイダー、医療機関・薬局に至るまでのサプライチェーンの各段階で、トレーサビリティーを電子的に管理するための取り組みを行っている。
同法が適用される取引パートナー(Trading Partner)は、以下の通りである。
- 製造業者(Manufacturers)
- 再包装業者(Repackagers)
- 卸売業者(Wholesale Distributors(WDDs))
- 調剤者(Dispensers)
- サードパーティーロジスティクス・プロバイダー(Third-party logistics providers (3PLs))
DSCSAでは、医薬品の受け渡しで所有権が移転するごとに、以下のようなデータを次の所有者に提供することが求められる。
- 取引情報(TI):製品名、規格用量、商品コード、ロット番号、取引日、取引に関わった両者の名称と住所など
- 取引履歴(TH):製造業者から現在までの各取引情報の記録(紙または電子媒体)
- 取引明細(TS): 所有権を譲渡する事業主体の記述(例.DSCSAで認証された事業体であること、製品を認証済事業主体より受領したことなど)
なお、データ保存期間は6年となっている。
次に図2は、DSCSAのパスを示したものである。
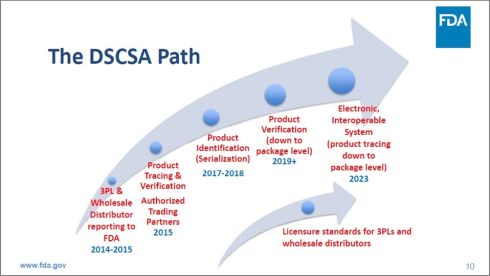 図2 医薬品サプライチェーン安全保障法(DSCSA)のパス(クリックで拡大) 出典:Food and Drug Administration (FDA) 「FDA Drug Topics: Enhanced Drug Distribution Security 2023 and Beyond」(2021年6月1日)
図2 医薬品サプライチェーン安全保障法(DSCSA)のパス(クリックで拡大) 出典:Food and Drug Administration (FDA) 「FDA Drug Topics: Enhanced Drug Distribution Security 2023 and Beyond」(2021年6月1日)2014〜2015年までに、医薬品卸売業者と3PLを対象としたFDAへの報告制度をスタートさせ、2015年までに、認定取引パートナーを対象とする製品トレーサビリティーおよび認証の仕組みを導入し、2017〜2018年までに、製品識別(シリアライゼーション)の仕組みを導入し、2019年以降、製品認証(包装単位まで下げる)の仕組みを導入し、2023年までに、電子的で相互運用性のあるシステム(製品トレーサビリティーを包装単位まで下げる)の導入を義務化する計画を提示している。また、FDAは、医薬品卸売業者および3PL のライセンスの連邦基準を作成するとしている。
Copyright © ITmedia, Inc. All Rights Reserved.
医療機器の記事ランキング
- 画像診断支援AI技術の開発を支援するクラウドサービスの提供を開始
- 持続感染性を有するウイルスの獲得に成功
- ポータビリティ性を高めたラップトップ型汎用超音波画像診断装置
- 医療機器よりも難題!? Non-SaMDに影響が及ぶ米国のIoTセキュリティ政策
- 生体外でほぼ100%毛幹を生み出せる、毛包オルガノイドを作製
- 高エネルギー電子線をレーザーで発生、より安全ながん治療装置の確立へ
- 3ステップ約3分で40種類の薬物を尿から検出する手法を開発
- 内視鏡システムのクラウド化に関する実証実験を開始
- 医薬品向け製造、品質管理システムのサプスクリプション型サービスを開始
- トウモロコシ由来のオリゴペプチドが肥満や脂肪肝を改善する


